Nicolas Desprat est diplômé en physique fondamentale de l’Université Pierre et Marie Curie. Il est titulaire d’un doctorat en matière condensée et est actuellement Maître de Conférence à l’Université de Paris. Ses recherches visent à comprendre comment les contraintes physiques façonnent les communautés microbiennes.
Contact
L277
0144323468 L296
Laboratoire de physique
de l’Ecole normale supérieure
24 rue Lhomond 75005 PARIS
Intérêts de recherche
- Communautés bactériennes
- Interactions hôte-pathogène
- Phénomènes collectifs chez l’algue Chlamydomonas reinhardtii
- Environnement fluctuant chez la levure Saccharomyces cerevisiae
- Evolution dans un environnement avec une structure spatiale
Communautés bactériennes
Morphogenèse de la microcolonie

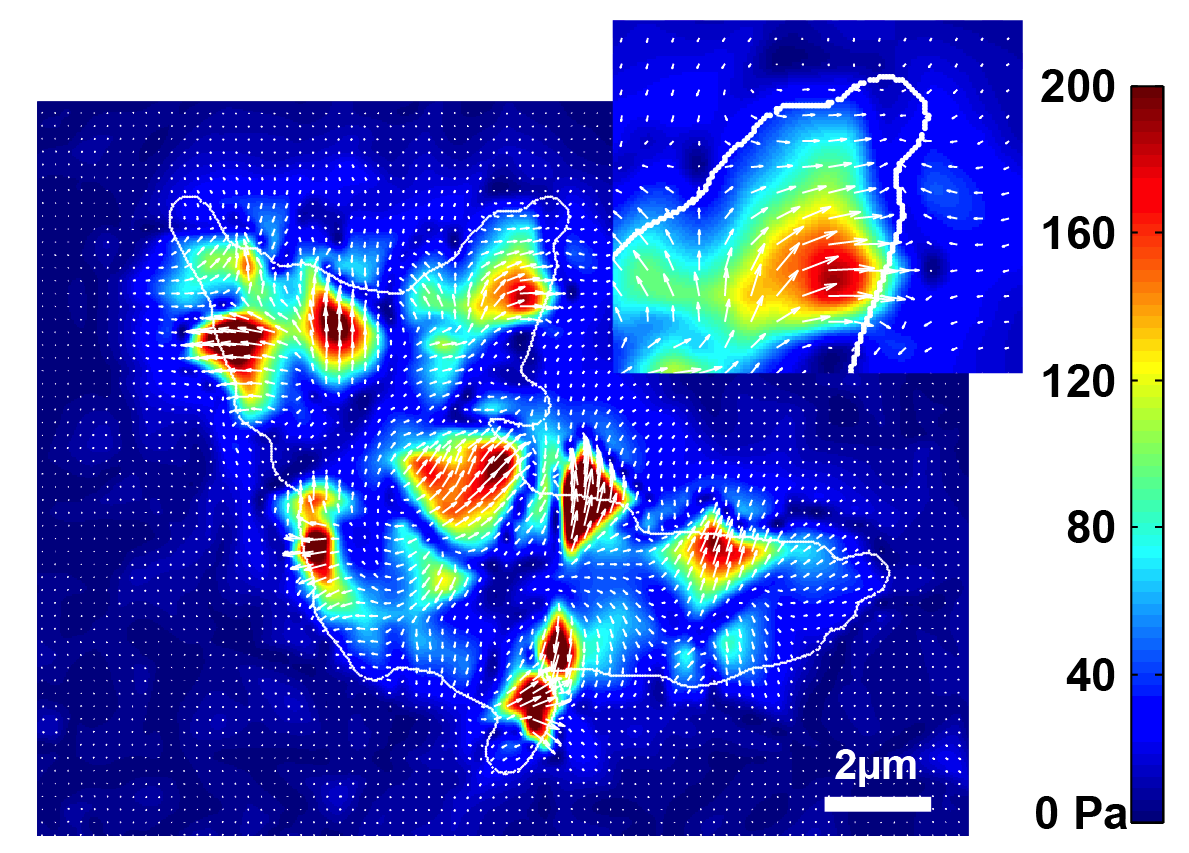
Les populations bactériennes interagissent avec les surfaces de manière à établir des communautés denses et sessiles. Les surfaces sont colonisées par des bactéries qui établissent d’abord une microcolonie en 2D sous la forme d’une monocouche de bactéries, qui se développe ensuite dans la troisième dimension. Grace à des experiences d’ablation de cellules uniques, de microscopie de force et de la modélisation mécanique, nous avons montré que l’adhésion asymétrique favorise la formation de monocouches circulaires en 2D qui maximisent les interactions entre cellules. Aujourd’hui nos travaux visent à comprendre les mécanismes cellulaires responsables de l’adhésion polaire. Ces travaux se font en collaboration avec Christophe Beloin (Génétique des biofilms, Institut Pasteur) et Arnaud Gautier (Sorbonne Université).
Secrétion d’un bien publique
De nombreuses enzymes essentielles à l’activité cellulaire incorporent du fer dans leur structure. La rareté du fer soluble dans les environnements aérobics a conduit la plupart des organismes à développer des mécanismes de sécrétion et d’importation pour acheminer le fer vers le cytoplasme grace à des sidérophores (chélateurs du fer). Dans un contexte où la diffusion rend l’investissement du cout métabolique de production vulnérable à l’exploitation par des cellules non-productrices, on est en mesure de se demander quels mécanismes permettent de se prémunir d’une telle exploitation ?
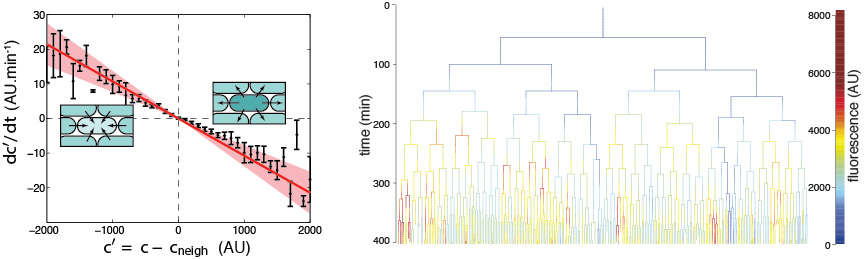
La bactérie Pseudomonas aeruginosa sécrète un sidérophore fluorescent, la pyoverdine. Nous avons montré que la concentration de pyoverdine contenue dans le périplasme des cellules fluctue dans le temps et est largement distribuée entre les cellules. Néanmoins, des mécanismes échanges locaux limitent la variabilité cellulaire en ajustant l’équilibre des concentrations entre cellules voisines. Cette étude a été menée en collaboration avec Thierry Mora (LPENS) et Isabelle Schalk (ESBS, UNISTRA).
Interactions hôte-pathogène
Dynamique de la vacuole d’internalisation lors de l’entrée de listeria dans des cellules épithéliales
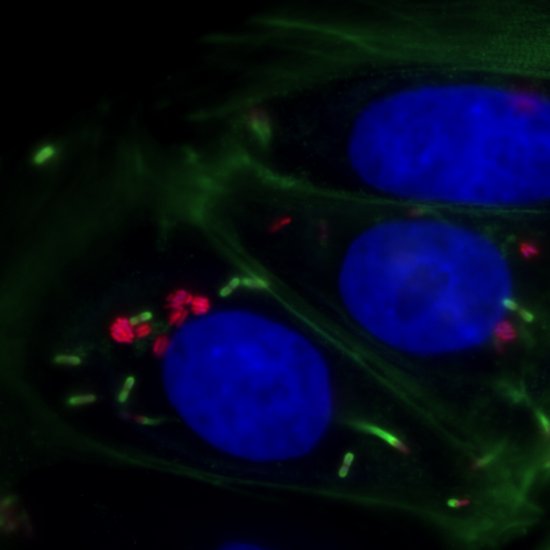
Listeria monocytogenes est une bactérie pathogène opportuniste responsable de la listériose. Son mécanisme infectieux est caractérisé par un cycle de vie intracellulaire. Elle entre dans les cellules qu’elle infecte par un mécanisme proche de l’endocytose et se retrouve enfermé dans une vacuole d’internalisation dont elle doit s’échapper afin de pouvoir se répliquer dans le cytoplasme de la cellule hôte. En collaboration avec Alice Lebreton (IBENS) et Arnaud Gautier (Sorbonne Université), nous avons pu montré que contrairement à la vision couramment acceptée, Listeria était capable de proliférer dans la vacuole d’internalisation avant de se retrouver au contact du cytoplasme de la cellule hôte (Peron et al., PLoS Pathogens 2020). Ces résultats nous amènent à nous demander quelle est le rôle de cette nouvelle niche intra-cellulaire dans le mécanisme infectieux (collaboration avec Marc Lecuit, Institut Pasteur).
Phénomènes collectif chez Chlamydomonas reinhardtii
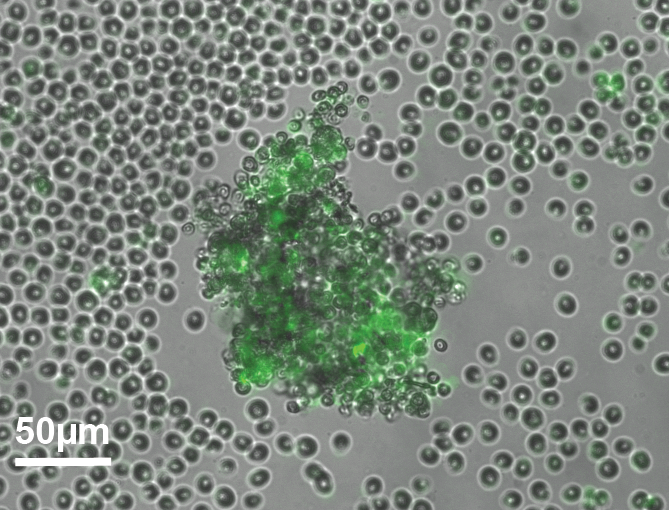
Aggregation
L’émergence de la multicellularité est l’une des transitions majeures de l’évolution. Elle s’est produite plusieurs fois dans l’histoire de la vivant. La multicellularité présente des avantages, mais la concurrence intraspécifique sur les ressources environnementales s’intensifie lorsque la taille du groupe augmente. Par conséquent, les conditions biologiques et physiques qui ont initialement conduit les cellules individuelles à former des groupes restent floues. Chlamydomonas reinhardtii est un système modèle adapté à cette étude car possédant des cousines multicellulaires. Ce projet propose d’explorer les mécanismes microscopiques qui sous-tendent la formation et la dispersion des groupes, qui sont les conditions préalables à la compréhension de l’écologie et de l’évolution des cycles de vie multicellulaires. Ce projet est réalisé en collaboration avec Antoine Danon (Sorbonne Université) et Raphaël Jeanneret (LPENS).
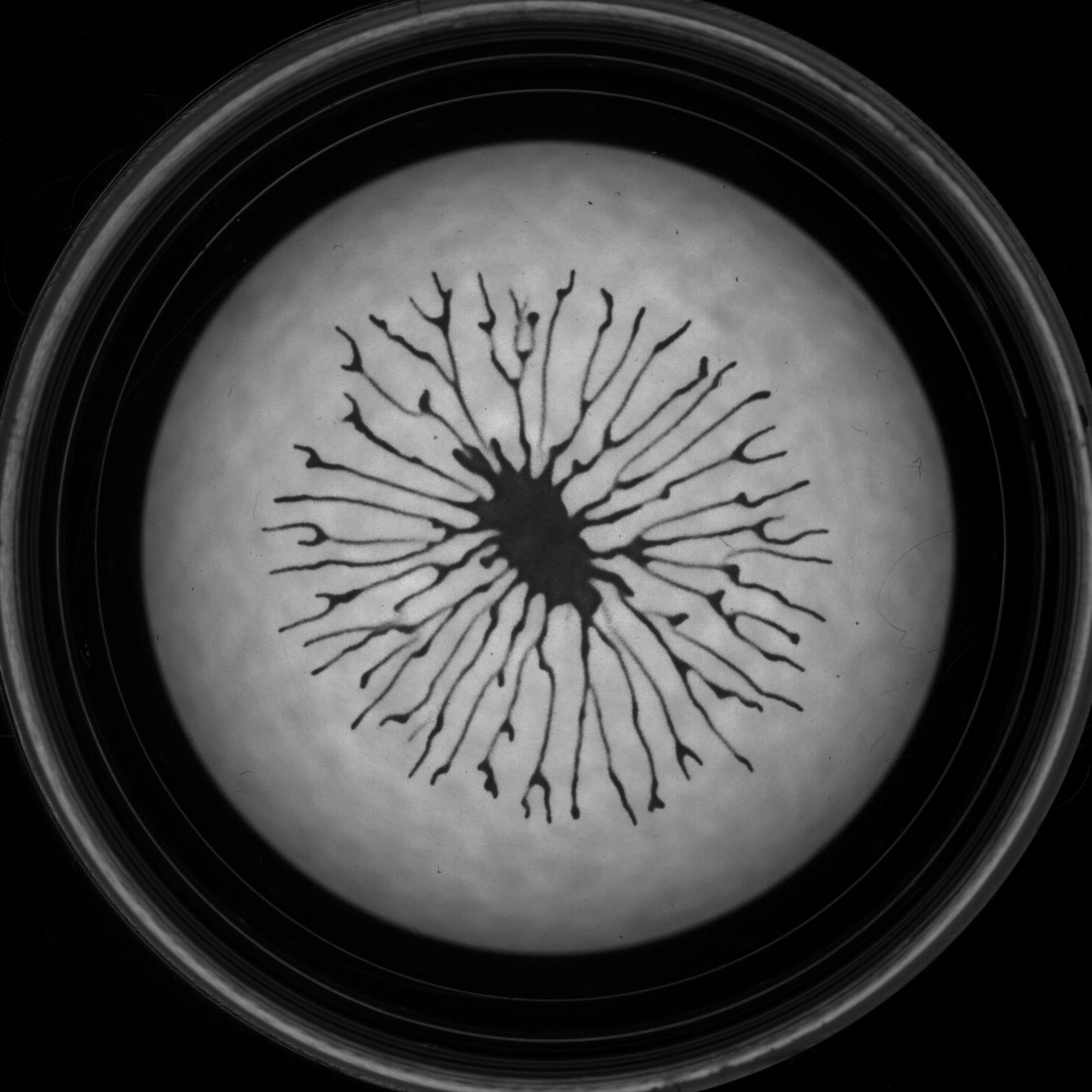
Phototaxie
L’algue verte Chlamydomonas reinhardtii est capable de s’orienter dans un gradient de lumière afin d’optimiser les conditions de la photosynthèse. Avec Raphaël Jeanneret (LPENS), nous avons récemment mis en évidence un nouveau comprtement collectif basé sur un couplage entre le champ de densité des algues et la propagation de la lumière qui conduit à la formation de motifs branchés.
Adaptation dans des environnements fluctuants
Sacharomyce cerevisiae
En collaboration avec Jean-Baptiste Boulé (MNHN), nous avons mis au point un bioréacteur entièrement automatisé permettant d’imposer des changements d’environnements soit préditibles soit aléatoires afin de mesurer l’adaptation physiologique de la levure Saccharomyces cerivisiae. Le projet consiste à déterminer si il existe des mécanismes permettant de diriger l’adaptation. Notre bioréacteur nous permet aujourd’hui d’entrainer pendant plusieurs mois une population en croissance.
Evolution dans un environnement spatialement structuré
Echerichia coli dans un gradient de température
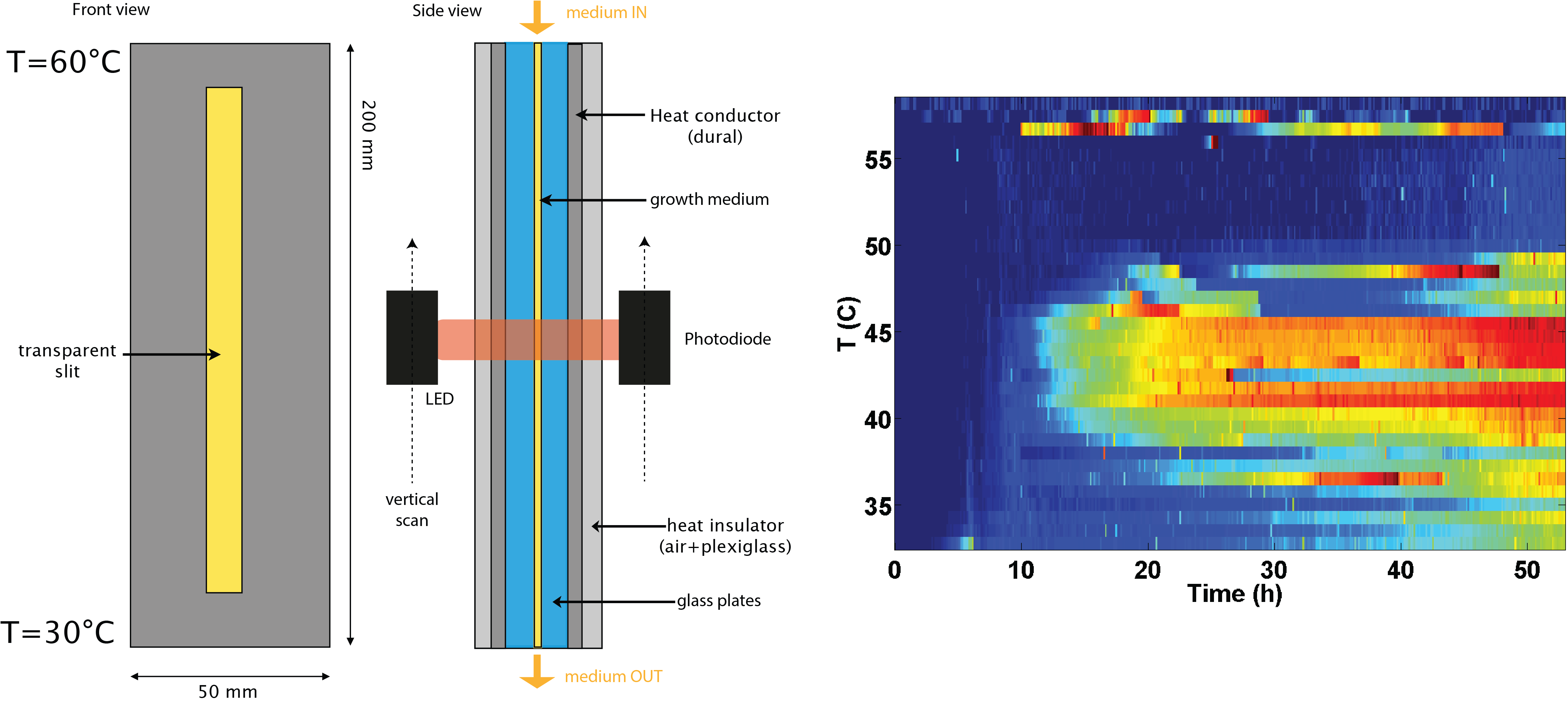
Les expériences d’évolution expérimentale mettent souvent en jeu des changements soudain de conditions dans un environnement homogène. Or la structure spatiale d’un environnement peut faciliter l’adaptation d’une population. Nous avons mis au point un chémostat permettant de cultiver en continu une culture de bactérie dans un gradient de température. La nourriture est apportée par le haut de la colonne qui est lui même maintenu à une température de 60°C et les bactéries sont évacuées par le bas maintenu lui à une température de 30°C. Pour E. coli, la température maximale de croissance est aux alentours de 45°C. Ainsi, les régions hautes de notre dispositif offrent des conditions favorables vis à vis de la concentration en nutriment mais ne sont pas propices à la croissance.
Publications
Les 5 dernières publications :
- Peron-cane C., Leblanc J., Gautier. A., Desprat* N., Lebreton* A. [2020] Fluorescent secreted bacterial effectors reveal an intravacuolar replication compartment for Listeria monocytogenes. PLoS Pathogens 16(10):e1009001.
- Chekli, C. Peron-Cane, D. Dell’Arciprete, J-F. Allemand, C. Li, J-M. Ghigo, A. Gautier, A. Lebreton, N. Desprat* and C. Beloin* [2020] Visualizing the dynamics of exported bacterial proteins with the chemogenetic fluorescent reporter FAST Sci Rep. Sep 10:15791.
- Duvernoy MC, Mora T, Ardré M, Croquette V, Bensimon D, Quilliet C, Ghigo JM, Balland M, Beloin C, Lecuyer S, Desprat N. [2018] Asymmetric adhesion of rod-shaped bacteria controls microcolony morphogenesis. Nat Commun. 2018 Mar 16;9(1):1120
- Hormoz S, Desprat N, Shraiman B. [2015] Inferring Epigenetic Dynamics from Kin Correlations. PNAS doi:10.1073/pnas.1504407112
- Gallie J, Libby E, Bertels F, Remigi P, Jendresen CB, Ferguson GC, Desprat N, Buffing MF, Sauer U, Beaumont UJE, Martinussen J, Kilstrup M, Rainey PB [2015] Bistability in a Metabolic Network Underpins the De Novo Evolution of Colony Switching in Pseudomonas fluorescens. PLoS biology 13:e1002109.
Curriculum Vitae
Situation actuelle
- Maître de Conférence – Université de Paris
- Equipe ABCD: Physics of Microbes
Cursus
- 2005-2007 : Postdoctorant INSERM à l’Institut Curie (UMR168) dans le groupe d’Emmanuel Farge (Mécanique et génétique du développement embryonnaire et tumoral). Interplay between developmental gene expression and morphogenetic movements in gastrulating drosophila embryos.
- 2001-2005 : Doctorat à l’Université Paris Diderot sous la direction d’Atef Asnacios (MSC) : Rhéologie cellulaire
- 2000 : DEA de physique du Solide et de la matière condensée (Université Pierre & Marie Curie)
Télécharger le CV complet : ![]()
Enseignement
- Stanford Overseas Program in Paris: Optique and Electromagnetisme
- Maître de Conférence à l’UFR de Physqiue (Université de Paris)